Grandes são os impactos dos gases gerados pelas aves em seu processo de produção devido à má qualidade do ar e umidade da cama, ocasionado principalmente por manejo inadequado das instalações (estruturas mal dimensionadas, falta de isolamento, falhas de projetos, falha no treinamento de mão de obra, entre outros).
Estes fatores impactam diretamente no status sanitário do lote, abrindo portas para agentes oportunistas presentes no ambiente. E na maioria dos casos, há uma correlação dos fatores causadores, predispondo ainda mais ao aparecimento de patologias que acometem o trato respiratório.
Sistema respiratório:
A função básica do trato respiratório das aves é a realização das trocas gasosas do oxigênio da atmosfera pelo gás carbônico do sangue, a hematose. Os sacos aéreos também desempenham nas aves importante função termorreguladora e de vocalização. Os pulmões das aves são rígidos e aderidos a parte dorsal da cavidade torácica, junto às costelas, sendo relativamente pequenos quando comparados aos dos mamíferos.
Nas aves, os pulmões são ligados a nove sacos aéreos. Essas estruturas estão distribuídas da seguinte maneira: dois cervicais, um interclavicular, dois torácicos anteriores, dois torácicos posteriores e dois abdominais. Os três primeiros são classificados como sacos aéreos craniais, enquanto os últimos são denominados caudais (ORR, 1986) (Figura 0.1).
Eles permitem uma alta eficiência de troca de gases do ar, visto que, após passar pelos sacos aéreos posteriores, o ar é forçado através dos pulmões por compressão dos brônquios primários, antes de retornar para o exterior (GARCIA et al., 2009). Apesar de possuírem pulmões rígidos e pequenos esse mecanismo permite que a ventilação ocorra de forma eficaz nas aves.
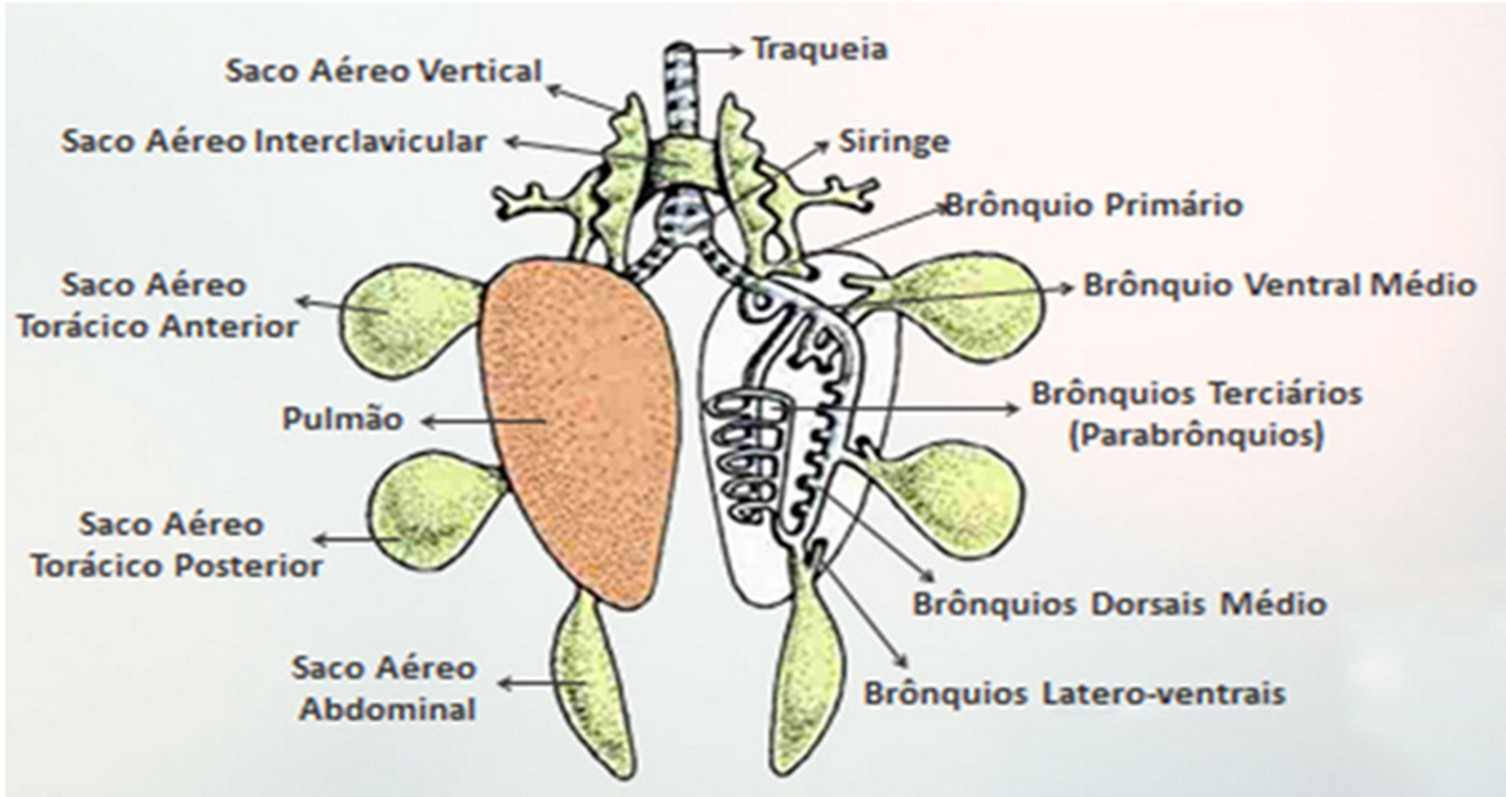
No entanto, devido a esse fator as aves ficam mais expostas aos agentes externos e variação do ambiente.
Sinais Clínicos:
Os sacos aéreos em sua forma normal, são membranas transparentes, muito finas e frágeis que se rompem facilmente ao toque durante a necropsia ou no abate (NT nº 4/2023/DINSP/CSI/CGI/ DIPOA/SDA/MAPA). No entanto, essa condição muda em caso de alterações inflamatórias. Os sacos aéreos tornam-se opacos, apresentam fibrose e, por vezes, acumulam conteúdo líquido e/ou espumoso, ou mesmo caseoso. O processo inflamatório dos sacos aéreos é denominado aerossaculite (NT nº 4/2023/ DINSP/CSI/ CGI/DIPOA/SDA/MAPA).
A aerossaculite de causa infecciosa pode apresentar diversificadas etiologias, desde bactérias e fungos chegando a algumas infecções virais. Entre os agentes mais encontrados estão: Mycoplasma gallisepticum, Escherichia coli e Aspergillus spp. E os menos frequentes, porém encontrados também em quadros de aerossaculite são: Coronavírus, Paramixovírus e Herpes vírus. No entanto, é muito frequente quadros de aerossaculite com vários agentes associados.
A aerossaculite geralmente está ligada a fatores ambientais e tem papel importante na manifestação e/ou na evolução do quadro clínico. Entre os vários fatores ambientais causadores da aerossaculite destaca-se a amônia (NH3), que se forma devido à falha na ambiência.
Os sinais clínicos apresentados pelas aves com aerossaculite podem variar, como: diminuição na produtividade, taquipnéia, pescoço alongado, respiração com o bico aberto, inquietação, respiração dificultosa, estertores e eriçamento de penas e em casos graves, aumento na mortalidade.
Além disso, aves com aerossaculite irão apresentar peso reduzido em relação as aves saudáveis, além de desuniformidade do lote prejudicando seu desempenho zootécnico e no final na linha de abate.
Agente:
Um dos pontos críticos na avicultura que está ligado diretamente a formação e liberação do NH3 está a cama do aviário, esta tem o papel de garantir conforto às aves ao absorver parte da umidade, diluir uratos e fezes, proporcionar isolamento térmico e diminuir lesões de peito, joelho e coxim plantar e problemas respiratórios (DE ANGELO et al., 1997; REFATTI et al., 2003; SANTOS et al., 2012).
Normalmente a cama é constituída por substratos inertes e sua qualidade depende da sua composição, tamanho das partículas, teor de umidade e grau de compactação (SMITH, 1956). Pode ser reutilizada por vários lotes, a fim de diminuir os custos de produção (VIEIRA, 2011), mas isso pode aumentar a umidade e propiciar a produção excessiva de amônia (GONZÁLES; SALDANHA, 2001) capaz de causar problemas as aves.
O excesso de umidade causada pelo mal manejo dos equipamentos, vazios sanitários curtos entre outros, contribui para a formação e liberação do gás, criando um ambiente inadequado, para o desenvolvimento das aves.
Dentre os agentes mais comuns e perceptíveis, o gás amônia (NH3) é tóxico e reconhecido como um dos contaminantes mais dominantes em galpões que abrigam frangos de corte (DAVID et al., 2015). Esta molécula provém da quebra do ácido úrico excretado pelos frangos de corte, e a taxa de emissão depende da umidade da cama, que tende a aumentar à medida que a excreta é acumulada no material (MILES; ROWE; CATHCART, 2011). Uma vez emitida, a amônia se acumula no interior do aviário até ser liberada para a atmosfera através do sistema de ventilação.
A amônia é muito irritante e é detectada pelas aves a partir de 15ppm, sendo 25ppm o limite máximo de exposição (BRANTON et al., 1991). Os humanos não detectam amônia abaixo de 20ppm e não a percebem como nociva até 50ppm. Desta forma, as aves são afetadas antes que o problema seja identificado pelos criadores (LOTT; DONALD, 2003).
O ajuste da ventilação e manejo adequado da cama é um mecanismo estratégico para manter uma adequada qualidade do ambiente no interior dos galpões.
Causas:
A crescente busca por novas tecnologias vem contribuindo cada vez mais para as aves poderem expressar seu potencial genético, porém com os avanços, se faz necessário uma mão de obra mais qualificada para manter e seguir corretamente os parâmetros dos equipamentos.
A climatização de galpões tem estimulado aumentos na densidade animal para reduzir custos e amortizar os investimentos (CRAVENER et al., 1992; GOLDFLUS, 1994). Todavia, o maior número de aves/m2 aumenta a compactação da cama, o que diminui sua capacidade de absorção (GRAÇAS et al., 1990; AVILLA et al., 1992) e eleva a concentração de amônia (HERNADES et al., 2002; ROSA, 2015). Assim, ambientes de alta densidade requerem melhor controle do teor de amônia, especialmente no final do ciclo produtivo (HERNADES et al., 2002), para evitar prejuízos ao bem-estar e à produtividade do lote (GARCIA et al., 2002).
Em galpões de alta densidade é necessário garantir a troca de ar por meio de ventilação, sem que a temperatura interna do galpão se torne crítica. Os nebulizadores precisam estar regulados para produzirem micro gotículas facilitando a evaporação da água e para não umedecer a cama. Os bebedouros e encanamentos precisam de manutenção para evitar derramamento de água na cama e, se ocorrer, é preciso haver substituição por substrato seco e ou trituração desta.
O correto dimensionamento, assim como as instalações são de extrema importância proporcionando uma dinâmica perfeita de acordo com as necessidades e desafios enfrentados nos ambientes externos e internos. Todavia as falhas nos projetos, levam a condições que na maioria das vezes vão impactar negativamente a produção.
Uso exacerbado de placas evaporativas e sistemas de umidificação durante o lote, interferem diretamente nos próximos alojamentos, onde uma cama mal trabalhada e com umidade elevada, aumenta a liberação de amônia o que afetara as aves no período mais crítico que se dá nas primeiras semanas.
A exposição de animais a altos níveis de amônia causa irritação das membranas mucosas e do trato respiratório, conjuntivite e dermatite.
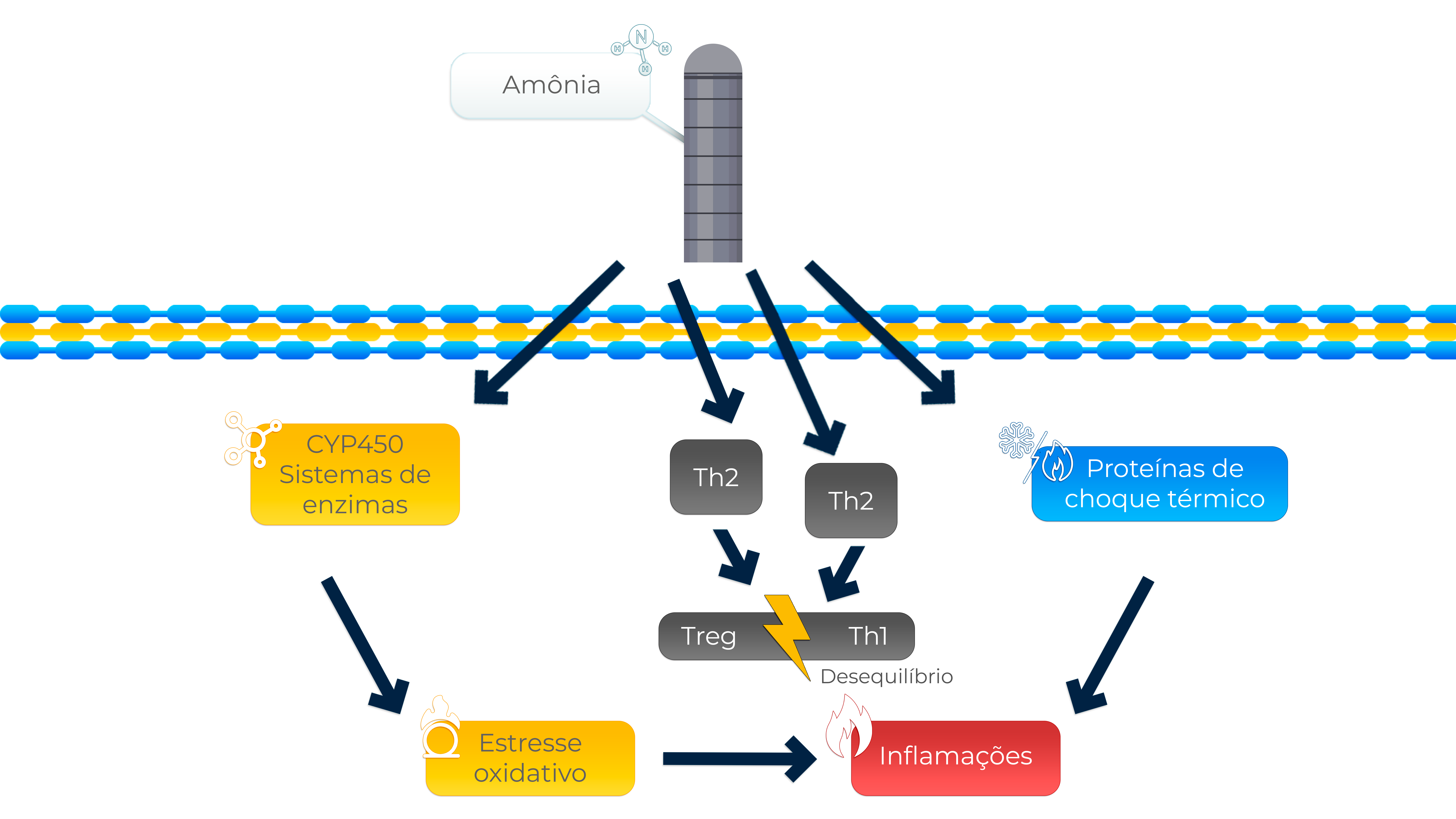
No sistema respiratório das aves, a traqueia atua como um canal de ar para a respiração e é a primeira linha de defesa contra poluentes. A exposição ao NH3 (0–3 semanas: 19,5–20,5 ppm; 3–6 semanas: 44,5 – 45,5 ppm) afeta diretamente a traqueia do frango, causando anormalidades na resposta imune traqueal no sistema respiratório. O aumento das células T auxiliares 2 ( Th2 ) e das células T auxiliares 17 (Th17) acelera o desequilíbrio das células reguladoras (Treg)/células T auxiliares 1 (Th1), causando inflamação das lesões da traqueia (Figura 2) (PUCHELLE et al., 1995; SHI et al. 2019).
Além disso, o estudo de Wang et al. (2019) mostrou que a exposição excessiva ao NH3 (30 ppm) causou uma resposta inflamatória nos neutrófilos do sangue periférico em frangos.
Estes fatores fazem com que haja um gasto metabólico da ave para o sistema imunitário, também aumenta a vascularização da área, abrindo portas para agentes expostos no ar.
Estudos indicam que em frangos de corte expostos à amônia, dióxido de carbono e poeira por seis dias consecutivos apresentam perda significativa de cílios a partir do epitélio da porção superior da traqueia, prejudicando o transporte de muco e a eliminação de partículas indesejáveis (ANDERSON et al., 1965). A partir de 10ppm de amônia, inicia-se a deterioração dos cílios do epitélio traqueal das aves e acima de 20ppm, há maior susceptibilidade às enfermidades respiratórias (GONZÁLES; SALDANHA, 2001).
Níveis de amônia acima de 25ppm paralisam alguns cílios, que deixam de filtrar contaminantes e concentrações de 50ppm, são capazes de destruir alguns cílios e causar uma série de alterações patológicas nas aves, incluindo o desenvolvimento de E. coli na traqueia (LOTT; DONALD, 2003). Acima de 60ppm de amônia, as aves tornam-se predispostas a doenças respiratórias e infecções secundárias até mesmo após vacinações (GONZÁLES; SALDANHA, 2001).
A exposição prolongada à grande concentração de amônia (75-100ppm) resulta em prejuízos à respiração (CHARLES et al., 1966), perda de cílios e aumento de células caliciformes (ANDERSON et al., 1965). Quando o nível de amônia atinge 100ppm, há redução na frequência e amplitude respiratória, prejudicando a troca gasosa (OLIVEIRA et al., 2002). Níveis de amônia entre 60 e 100ppm podem ser observados no início de ciclos produtivos quando se reutiliza cama (GONZÁLES; SALDANHA, 2001).
Considerações Finais
Os impactos negativos gerados pelo mal controle do ambiente das aves afetam diretamente o desempenho e status sanitário do lote, abrindo assim portas para agentes oportunistas e causando prejuízo para a criação.
O dimensionamento incorreto, somado à falta de manutenção e ao manejo inadequado das instalações, inevitavelmente impactará o desempenho zootécnico e a imunidade dos animais.
Dentre as várias consequências está a formação em excesso da amônia, que se encontra entre um dos principais causadores destes problemas pelo seu impacto negativo no sistema de defesa da ave.
O conhecimento sobre a forma correta de operação dos sistemas de climatização, assim como uma boa instalação, nos permite minimizar e até neutralizar estes efeitos negativos na produção, proporcionando o bem-estar animal, refletindo em seu melhor desempenho tanto produtivo como em sua resposta imunológica as vacinações e agentes nocivos presentes no ambiente.
Bibliografia:
DE ANGELO, J. C.; GONZÁLES, E.; KONDO, N.; ANZAI, N. H.; MEDEIROS, M. C. Material de cama: qualidade, quantidade e efeito sobre o desempenho de frango de corte. R Bras Zootec, 26, p.121-130.
REFATTI, R.; RESTELATTO, R.; ZIELINSKI, R. P.; PAIXÃO, S. J.; MENDES, A. S. Tipos de cama e pesos iniciais ao alojamento sobre os parâmetros de umidade da cama e de incidências de lesões em frangos de corte. Anais… 3o Seminário sobre Sistemas de Produção Agropecuária – Zootecnia. Dois Vizinhos, Brasil. 2003. Disponível em: . Acesso em: 01 nov. 2015.
SANTOS, M. J. B.; SAMAY, A. M. A. T.; SILVA, D. A. da; REBELLO, C. B. V.; TORRES, T. R.; SANTOS, P. A.; CAMELO, L. C. L. Manejo e tratamento de cama durante a criação de aves. R Eletron Nutrilime 9, p.1801-1815, 2012.
SMITH, R. C. Kind of litter and breast blister on broilers. Poult Sci, 35, p.593-595, 1956.
HERNADES, R.; CAZETTA, J. O.; DE MORAES, V. M. B. Frações nitrogenadas, glicídicas e amônia liberada pela cama de frangos de corte em diferentes densidades e tempos de confinamento. R Bras Zootec, 31, p.1795-1802, 2002.
GONZÁLES, E.; SALDANHA, E. S. P. B. Os primeiros dias de vida do frango e a produtividade futura. Anais… 38o Congresso Brasileiro de Zootecnia. Goiânia, Brasil. p.312-313.
ANDERSON, D. P.; BEARD, C. W.; HANSON, R. P. Influence of poultry house dust, ammonia and carbon dioxideon the resistance of chicken to Newcastle disease virus. Avian Dis, 20, p.177-188, 1965.
VIEIRA, M. F. A. Caracterização e análise da qualidade sanitária de camas de frango de diferentes materiais reutilizados sequencialmente. 81f. Dissertação de Mestrado (Mestrado em Engenharia Agrícola). Universidade Federal de Viçosa, Viçosa. 2011. Disponível em: Acesso em: 30 out. 2015.
GARCIA, R. G.; MENDES, A. A.; GARCIA, E. A.; NÄÄS, I. A.; MOREIRA, J.; ALMEIDA, I. C. L.; TAKITA, T. S. Efeito da densidade de criação e do sexo sobre o empenamento, incidência de lesões na carcaça e qualidade da carne de peito de frangos de corte. Rev Bras Cienc Avic, 4, p.1-9, 2002.
MILES, D. M.; BROOKS, J. P.; MC LAUGHLIN, M. R.; ROWE, D. E. Broiler litter ammonia emissions near sidewalls, feeders, and waterers. Poult Sci, 92, p.1693-1698, 2013.
BRANTON, S. L.; MASLIN, W. R.; MILLER, W. W.; SIMMONS, J. D. Histologic and ophthalmic effects of graded ammonia concentrations and duration of exposure on the chicken eye. Poult Sci, 70 (suppl. 1), p.149, 1991.
CRAVENER, T. L.; ROUSH, W. B.; MASHALY, M. M. Broiler production under varying population densities. Poult Sci, 71, p.427-433.
GOLDFLUS, F. Viabilidade da criação de frangos de corte sob alta densidade populacional. 126f. Dissertação de Mestrado (Mestrado em Produção Animal). Universidade Estadual Paulista, Jaboticabal. 1994.
CHARLES, D. R.; PAYNE, C. G. The influence of graded levels of atmospheric ammonia on chickens. I. Effects on respiration on the performance of broilers and replacement growing stock. Br Poult Sci, 7, p.177-187, 1966.
ANDERSON, D. P.; BEARD, C. W.; HANSON, R. P. Influence of poultry house dust, ammonia and carbon dioxideon the resistance of chicken to Newcastle disease virus. Avian Dis, 20, p.177-188, 1965.
OLIVEIRA, M. C.; GOURLART, R. B.; SILVA, J. C. N. Efeito de duas densidades e dois tipos de cama sobre a umidade da cama e a incidência de lesões na carcaça de frangos de corte. Cienc Rural, 3, p.7-12, 2002.
ORR, R. T. Biologia dos Vertebrados. 5ª. ed. São Paulo: Rocca, 1986. 508p. www.vetprofissional.com.br/artigos/fisiologia-respiratoria-nas-aves-regulacao- -da-respiração.
HINTZ, T.; LINKE, S. A comprehensive experimental study of aerial pollutants in and emissions from livestock buildings. Part 1: Methods. J Agr Eng Res, 70, p.111-119, 1998.
LOTT, B.; DONALD, J. Amônia: Grandes perdas mesmo quando você não percebe. Avicultura Industrial. 2003. Disponível em: <http://www.aviculturaindustrial.com.br/>. Acesso em: 23 mar. 2015.
E. PUCHELLE, S. DE BENTZMANN, JM ZAHM; Propriedades físicas e funcionais das secreções das vias aéreas na fibrose cística – abordagens terapêuticas. Respiração, 62 (Supl. 1) (1995), pp. 2 – 12
Q.X. Shi, W. Wang, M.H. Chen, H.F. Zhang, S.W. Xu; Ammonia induces Treg/Th1 imbalance with triggered NF-κB pathway leading to chicken respiratory inflammation response, Sci. Total Environ., 659 (2019), pp. 354-362









































Otimo excelente!