Influenza A em suínos
Dentre os agentes mais comuns, o Vírus Influenza A (VIA) consegue infectar uma grande variedade de animais e espécies, como: humanos, suínos, equinos, mamíferos aquáticos, aves de produção e aves silvestres. Segundo Dias (2015), os suínos têm importante papel na epidemiologia do VIA, pois a espécie pode se infectar com vírus de origem humana e aviária, atuando como hospedeiro intermediário na transmissão viral e facilitando a formação de novas amostras virais que podem causar epidemias.
A contaminação do VIA pode ocorrer através do contato direto entre suínos sadios e animais infectados, além do contato indireto com objetos e superfícies contaminadas, podendo levar a uma distribuição rápida do vírus no plantel, devido sua grande habilidade em persistir na forma endêmica em granjas de ciclo completo. A transmissão por aerossóis também é considerada uma rota de transmissão do vírus, podendo permanecer viável por 10 horas em superfícies porosas e por 48 horas em superfícies não porosas e nas mãos, dependendo da umidade relativa do ar (Corzo et al., 2013).
Figura 1: Distância do possível percurso de patógenos pelo ar:
| PATÓGENOS | DISTÂNCIA |
| Maioria das bactérias | 300-500 metros |
| Mycoplasma hyopneumoniae | 3200 metros |
| Vírus Influenza A e Actinobacillus Pleuropneumoniae | 7000 metros |
| Vírus de Aujeszky, Aftosa e Peste Suína Clássica | 40000 metros |
Fonte: Capacitação tecnológica suinocultura, Rohr 2016.
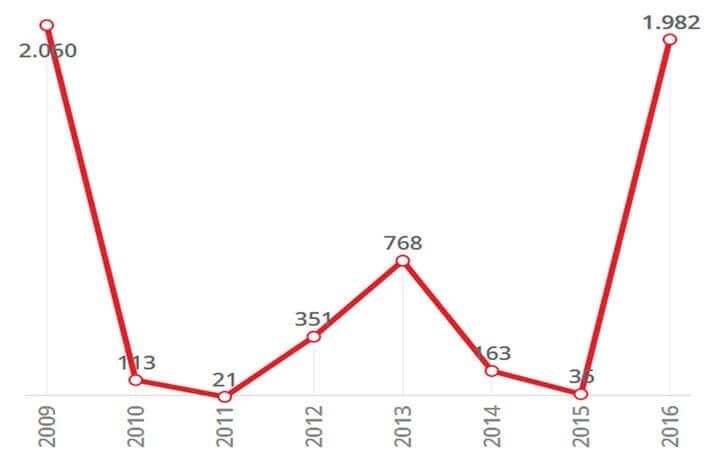
Na suinocultura brasileira, os surtos ocorrem entre os meses de maio e setembro, período ao qual se inicia as variações de temperatura ambiente, no entanto, em regiões onde há grande variação térmica diária, a chance de ocorrência também é bastante elevada durante todo o ano. Da mesma forma, o médico Dr. Carlos Jardim, em reportagem para o site www.cidadeverde.com, afirma que a gripe nos humanos ocorre ao longo do ano, porém, é mais frequente no inverno, principalmente nas regiões onde as condições climáticas são mais definidas. Em 2016, o Ministério da Saúde brasileiro realizou 10.625 notificações dos casos de Vírus Influenza em humanos, sendo o H1N1 responsável pela mortalidade de 1.982 pessoas e o conjunto de Vírus Influenza vitimou 2.220 pacientes.
Figura 2: Mortes por H1N1 no Brasil desde a primeira pandemia:
Sinais clínicos em suínos:
Nos rebanhos de ciclo completo, os animais mais acometidos estão nas fases de creche, recria e terminação. A partir da entrada do vírus H1N1 pandêmico e a ausência de imunidade nos rebanhos, lesões histológicas graves sugestivas de VIA foram observadas nos pulmões de suínos em diversas idades (de leitões lactentes a animais na terminação), em diversos estados brasileiros (Watanabe et al., 2012).
Quando há um surto na granja, os sinais clínicos provocados são: doença respiratória aguda, taquipneia, tosse, febre (40 – 41,5°C), baixo consumo de ração, apatia, conjuntivite e descarga nasal, sendo esses sintomas manifestados em suínos, mas, parecidos com os sintomas dos humanos (Vicent et al., 2008). Dependendo da cepa viral, a idade dos animais, a condição imunológica, a presença de patologias concomitantes e oportunistas, indicarão como o plantel poderá reagir ao vírus em circulação. A recuperação clínica pode ser rápida, entre 5 a 7 dias após o início dos sinais, desde a não ocorrência de infecções secundárias.
Diagnostico clínico:
As doenças respiratórias dos suínos se manifestam nos rebanhos industriais como uma síndrome denominada “Complexo de Doenças Respiratórias dos Suínos”, por resultarem de uma combinação de dois ou mais agentes infecciosos, como também dos fatores de riscos, induzindo os animais a apresentarem um quadro patológico complexo e de difícil controle (Fablet et al., 2012).
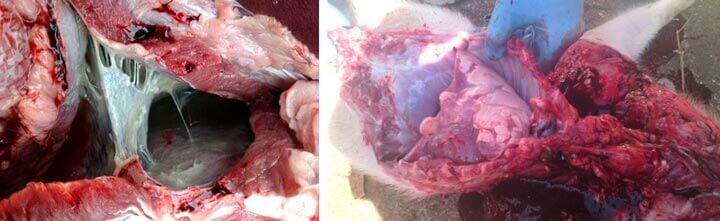
Na necropsia, as lesões características da infecção pelo VIA geralmente são limitadas aos lobos apical e cardíaco. Mais da metade do pulmão pode ser acometida em casos de infecção severa. É observada uma linha bem demarcada entre o tecido pulmonar normal e o afetado, consolidação vermelho-escura, edema interlobular, vias aéreas repletas de espuma e sangue, podendo haver exsudato fibrinoso e aumento de linfonodos bronquiais e do mediastino. Em casos mais graves, pode-se observar pleurite fibrinosa. Todos estes achados de necropsia dificultam o diagnóstico clinico, devido às características das lesões serem bem parecidas com outras patologias e infecções do “Complexo de Doenças Respiratórias dos Suínos”. De acordo com López (2012), essas lesões macroscópicas podem ser indistinguíveis daquelas causadas por Mycoplasma hyopneumoniae e segundo Van Reeth et al., (2012) em muitos casos, as lesões induzidas pelo VIA estão mascaradas por broncopneumonias bacterianas.
Figura 2: Envolvimento de patologias do Complexo Respiratório dos Suínos:
Outros agentes causadores de doenças respiratórias podem estar atuantes no plantel, agravando a infecção pelo VIA. Infecções secundárias por bactérias do trato respiratório, como: Actinobacillus pleuropneumoniae, Pasteurella multocida, Haemophilus parasuis, Streptococcus suis tipo 2 e pelo Mycoplasma hyopneumoniae, aumentam a severidade e o curso da infecção do VIA. Outros vírus respiratórios, como: o Circovírus Suíno tipo 2, o Coronavírus Respiratório Suíno e o Vírus da Síndrome Respiratória e Reprodutiva Suína (esses dois últimos não diagnosticados no Brasil), também podem agir como fator de complicação, aumentando o curso e a gravidade da doença (Choi et al., 2003).
Nos dias atuais, o VIA está sendo encontrado em leitões de creche, em associação com o Haemophilus parasuis, e na terminação o Mycoplasma hyopneumoniae e a Pasteurella multocida, são os agentes mais comumente encontrados em associação ao VIA (Barcellos et al., 2017).
Outro fator importante são as manifestações agudas e crônicas de intoxicações com micotoxinas, que agravam o estado de saúde do rebanho, quando há um consumo de doses moderadas a altas ou doses baixas por períodos prolongados, isto, leva a uma imunossupressão dos suínos podendo facilitar a ação conjunta com outras enfermidades.
Opções de diagnóstico laboratorial:
Para o melhor diagnóstico do VIA é necessária uma seleção correta dos suínos para a colheita de material. Deve-se selecionar animais na fase aguda da doença, febris, com ou sem tosse.
– Diagnóstico virológico e molecular: amostras de secreção nasal, pulmonar e/ou oral. O teste de PCR (transcrição reversa em cadeia da polimerase) tem facilitado o diagnóstico da infecção por Influenza A, através da detecção sequencial genômica do ácido nucléico viral de forma sensível e específica (Wang et at., 2010);
– Diagnóstico anátomo-histopatológico e imuno-histoquímico: amostra do pulmão;
– Diagnóstico sorológico: amostras de sangue e fluido oral. O teste sorológico mais utilizado para a detecção do VIA é a inibição da hemaglutinação (HI). Porém, apesar de largamente utilizada, a HI apresenta problemas relacionados à presença de inibidores inespecíficos da hemaglutinação ou à ocorrência de alterações genéticas virais que podem comprometer o resultado do teste (Wood et al., 1994).
Em avaliações amostrais de suínos, com sinais clínicos de Influenza A em seis estados brasileiros, a detecção do agente etiológico envolvido foi confirmada por isolamento viral, imuno-histoquímica e PCR (Rajão et al., 2013).
Tratamento:
O tratamento da infecção de Influenza A por VIA se torna difícil, como qualquer outra infecção viral que acomete os suínos. Expectorantes ou mucolíticos diminuem a viscosidade das secreções e agem como bronco dilatadores, favorece o controle das tosses, altera a permeabilidade pulmonar e melhora a atuação das imunoglobulinas e dos antibióticos. Os antimicrobianos injetáveis ou as rações medicadas podem ser utilizados para tratamento de infecções bacterianas secundárias, em caso de surtos no rebanho, dependendo dos agentes presentes na granja. Recomenda-se o uso de anti-inflamatórios por via hídrica para reduzir os efeitos da febre e a morbidade durante e após a fase aguda da infeção (Hawkins et al., 2010).
Prevenção e controle:
Para prevenção da maioria das patologias que afetam a saúde dos suínos é necessário tomar medidas de biosseguridade, nutricionais, ambientais e vacinais do rebanho.
Como medidas de biosseguridade devemos avaliar:
– Introdução de novos animais nas granjas, através de quarentena e do controle da origem desses animais.
– Limpeza e desinfecção das instalações antes da entrada de novos lotes.
– Vazio sanitário, que somado à desinfecção, permite a destruição dos patógenos não eliminados no processo de lavação.
– Dispor de um sistema de desinfecção para a introdução de materiais e equipamentos na granja (ex.: fumigação), ajuda a prevenir a entrada de patógenos.
– Métodos de pulverização ou arcos de desinfecção, com uso de desinfetantes (ex.: rodolúvio), são procedimentos capazes de evitar que veículos entrem com patógenos na granja.
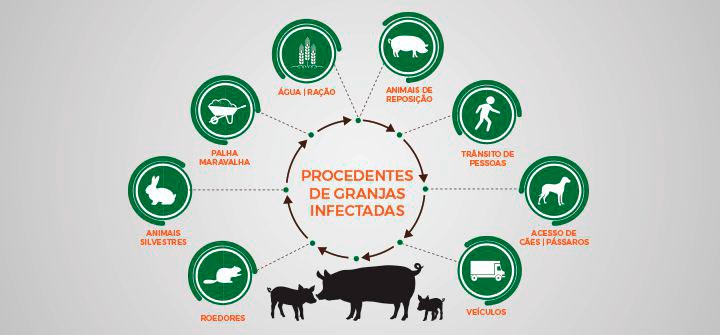
Figura 3: Modo de transmissões das doenças nas granjas:
– As pessoas que precisarem entrar na granja devem fazer a troca de calçados e roupas, se possível, adotar a prática de tomar banho; o banho antes da entrada na granja é uma alternativa para prevenção da condução de patógenos para dentro da granja. O funcionário ou visitante deve entrar na área destinada aos banhos somente com as vestimentas do corpo. O banheiro é dividido em: área suja, intermediária e área limpa. Portanto, nesta primeira área, o visitante deverá deixar todos os pertences pessoais, onde deverão ser armazenados nos armários juntamente com a roupa “suja”. Após o banho, ele não poderá retornar à área suja, mas deverá ser orientado a pegar a toalha e roupas oferecidas na área “limpa”.
– “Cinturão verde”, formado por espécies de árvores plantadas em determinadas áreas ao redor da granja, é utilizado para diminuir ou eliminar correntes de ventos, evitando a condução de microrganismos patogênicos para dentro da granja.
Figura 5: Cinturão verde plantado com eucaliptos ao redor dos sítios:

Segundo Easterday et al. (1999), caso os trabalhadores da granja apresentem sintomatologia sugestiva de Influenza A, principalmente febre alta e espirros, pede-se a suspensão do trabalho até a recuperação total, evitando assim a possível transmissão interespécie (homem e suíno). Além disso, a vacinação dos funcionários, uma vez ao ano, é uma ferramenta importante na prevenção da doença nas espécies. Com o objetivo de reduzir a circulação do vírus, a vacina também tem como consequência diminuir a gravidade dos sintomas clínicos, principalmente, nas pessoas que se enquadram na lista dos fatores de riscos ou não tomam de atitudes preventivas de evitar o contágio do VIA.
Alguns fatores de riscos ao qual devemos levar em consideração na produção, são:
– Temperatura ambiente nas salas e galpões fora da zona de conforto para a fase de criação ou com amplitude térmica elevada no mesmo dia (maior de 8°C);
– Excesso de animais nas baias de creche, recria e terminação;
– Inadequada relação do número de suínos por bebedouro e comedouro;
– Falta, temperatura elevada ou baixa qualidade da água.
A vacinação do rebanho induz altos títulos de anticorpos, prevenindo os sinais clínicos, além de reduzir a eliminação viral e as lesões pulmonares, mas a grande diferença genética e antigênica do VIA circulantes em diferentes regiões, resulta em variação na composição das vacinas, isto dificulta em mantê-la sempre atualizada nos países onde se realizam a vacinação dos animais, inclusive no Brasil.
Concluindo:
O Vírus Influenza A e o Mycoplasma hyopneumoniae são os agentes primários na indução de problemas respiratórios dos suínos, com participação importante do Haemophilus parasuis, da Pasteurella multocida e, em alguns rebanhos, o Actinobacillus pleuropneumoniae, sendo esses primários ou oportunistas, com forte participação no “Complexo de Doença Respiratória dos Suínos”.
A infecção pelo VIA nos suínos é restrita ao trato respiratório, ou seja, o vírus não está presente em outros tecidos, como o tecido muscular (Vincent et al., 2009). Portanto, a carne suína é segura para o consumo humano e, de acordo com a Organização Mundial de Saúde Animal (OIE), a presença de Influenza A em suínos não deve ser considerada barreira para o comércio internacional da carne suína.
É de extrema importância não medir esforços para utilizar maneiras de impedir a entrada de novos agentes nas granjas, combater aqueles já estabelecidos no plantel ou elimina-los, visando diminuir os surtos e as perdas que possam ocorrer. As medidas para o comprometimento de todos, são: biosseguridade, trabalho nutricional, itens para execução das propostas, treinamento da equipe, entendimento do complexo respiratório (agentes envolvidos), diagnóstico adequado e terapia de suporte.
Agroceres Multimix. Nutrição Animal.
Referências bibliográficas:
BARCELLOS, D.E.S.N.; TAKEUTI, K.L.; ALMEIDA, L.L.; OLIVEIRA FILHO, J.X. Interação entre agentes infecciosos bacterianos e virais no complexo de doenças respiratórias dos suínos. In: Avanços em sanidade, produção e reprodução de suínos. Eds. In: XVIII Congresso Bras. ABRAVES. Anais. Goiânia. 2017, p. 157.
CHOI, Y.K.; GOYAL, S.M.; JOO, H.S. Retrospective analysis of etiologic agents associated with respiratory diseases in pigs. Can. Vet. J., v.44, p.735-737, 2003.
CORZO, C.A.; CULHANE, M.; DEE, S.; MORRISON, R.B.; TORREMORELL, M. Airborne Detection and Quantification of Swine Influenza A Virus in Air Samples Collected Inside, Outside and Downwind from Swine Barns. PLOS One, v.8 (8), acesso e71444, 2013.
DANTAS, C. Brasil tem mais de 1,9 mil mortes por H1N1 em 2016. 2017. Dísponivel em: https://g1.globo.com/bemestar/noticia/brasil-tem-mais-de-19-mil-mortes-por-h1n1-em-2016-diz-ministerio.ghtml. Acesso: 17 de novembro de 2017.
DIAS, A.S., 2015. Influenza a: detecção de anticorpos e subtipos virais em suínos do brasil e estados unidos. Tese de doutorado em Ciência Animal da Universidade Federal de Minas Gerais.
EASTERDAY B.C.; VAN REETH K.; STRAW B.E; D’ALLAIRE S.D.; MENGELING W.L.; TAYLOR D.J. Swine influenza, Diseases of swine, 1998th ed. Ames, Iowa State University Press p. 277-90
FABLET, C.; MAROIS-CRE´HAN, C.; SIMON, G.; GRASLAND, B.; JESTIN, A.; KOBISCH, M.; MADEC, F.; ROSE, N. Infectious agents associated with respiratory diseases in 125 farrow-to-finish pig herds: A cross-sectional study. Vet. Microb., v.157, p.152–163, 2012.
HAWKINS, P.A.; WINKELMAN, N.; STROBEL, M.; MONDACA, E. Effect of ibuprofen, aspirin or saline water medications on pigs challenged with swine influenza vírus (SIV). Proceedings of the 21st International Pig Veterinary Society Congress, Vancouver, Canada, July 18 to 21, 2010, p. 269.
JARDIM, C., 2015. Tudo sobre a gripe. Disponível em: https://cidadeverde.com/vida/67600/especialista-explica-tudo-sobre-a-gripe. Acesso em: 05 de agosto de 2017.
LÓPES, A. 2012. Respiratory system, mediastinum, and pleurae, p.458-538. In: Zachary J.F. & McGavin M.D. (Eds), Pathologic Basis of Veterinary Disease. 5th ed. Mosby Elsevier, St Louis.
RAJÃO, D.S.; COUTO, D.H.; GASPARINI, M.R.; COSTA, A.T.R.; REIS, J.K.P.; LOBATO, Z.I.P.; GUEDES, R.M.C. & LEITE, R.C. Diagnosis and clinic-pathological findings of influenza virus infection in Brazilian pigs. Pesquisa Veterinária Brasileira. 33(1), 30-36, 2013.
Rohr, S.; CAPACITAÇÃO TECNOLÓGICA, 2016. Suinocultura, biosseguridade. Disponível em: https ://www.youtube.com/watch?v=m3_TCVBXtgA
VINCENT, A. L.; MA, W.; LAGER, K. M.; JANKE, B. H.; RICHT, J. A. Swine Influenza Viruses: A North American Perspective. In: MARAMOROSCH, K.; SHATKIN, A.J.; MURPHY, F. A. (Eds). Advances in Virus Research. Vol. 72. Burlington: Academic Press, p.127-154, 2008.
VINCENT, A. L.; MA, W.; LAGER, K. M. et al. Characterization of a newly emerged genetic cluster of H1N1 and H1N2 swine influenza virus in the United States. Virus Genes, v. 39, p. 176–185, 2009.
VAN REETH, K.; MA, W. Swine influenza vírus vacines – to change or not to change: that´s the question. Curr Top Micro Immu, doi: 10.1007/82_2012_266, 2012.
WANG, R.; TAUBENBERGER, J.K. Methods for molecular surveillance of influenza. Expert Rev Anti Infect Ther. v. 8 (5), p. 517–527, 2010.
WATANABE, T.T.N.; ALMEIDA, L.L.; WOUTERS, F.; WOUTERS, A.T.B.; ZLOTOWSKI, P. & DRIEMEIER, D. Histopathological and immunohistochemical indings of swine with spontaneous influenza A infection in Brazil, 2009-20101. Pesquisa Veterinária Brasileira. 32(11), 1148-1154, 2012.
WOOD, J.M.; GAINES-DA, S R.E.; TAYLOR, J.; CHAKRAVERTY, P. Comparison of influenza serological techniques by international collaborative study. Vaccine, v. 12, p. 167–174, 1994.