No dia 15 de maio de 2023, o MAPA (Ministério da Agricultura e Pecuária) publicou a Portaria Nº 798, que revoga as Instruções Normativas Nº 65/2006 e Nº 14/2016, trazendo as novas regras para a fabricação e emprego de produtos destinados à alimentação animal com medicamentos de uso veterinário.
A nova legislação estabelece as medidas que devem ser aplicadas para o uso racional de medicamentos na cadeia de alimentação animal, com foco em mitigar os riscos relacionados à resistência aos antimicrobianos e seus impactos à saúde humana e dos animais.
Mas, o que muda com a nova legislação? Preciso de autorização para utilizar medicamentos na minha fábrica de ração? Que obrigações tenho que cumprir? Qual o prazo que tenho para atender as mudanças necessárias?
A primeira regra é: apenas os estabelecimentos previamente autorizados pelo MAPA poderão fabricar produtos para alimentação animal contendo medicamentos na sua formulação, incluindo as fábricas dos produtores rurais.
“Mas eu só fabrico produtos para alimentar os meus próprios animais, preciso de autorização?”
Sim, qualquer estabelecimento fabricante de produto com medicamento precisa estar autorizado.
“Isso quer dizer que vou ter que registrar a minha fábrica no MAPA?”
Se a fabricação desses produtos é “para uso próprio” o estabelecimento não precisa de registro.
“Eu não fabrico, mas compro ração com medicamento… ainda assim preciso estar autorizado?”
Nesse caso não precisa de autorização.
A seguir, vamos entender um pouco melhor:
- como são classificados os produtos com medicamentos,
- como são classificados os estabelecimentos fabricantes e
- quais regras que se aplicam a cada situação.
Produtos medicamentosos
Na nova lei, produtos destinados à alimentação animal contendo medicamentos de uso veterinário na sua formulação são denominados como produtos medicamentosos.
Destes, os que estão prontos para serem fornecidos aos animais, tais como ração ou suplemento, são os produtos de pronto uso medicamentosos. Já os produtos que não estão prontos para serem fornecidos aos animais, devendo ser misturados a outros ingredientes, tais como premix, núcleo ou concentrado, são denominados produtos intermediários medicamentosos.
Observação: aditivos antimicrobianos melhoradores de desempenho e aditivos anticoccidianos, embora sejam classificados como produtos de uso veterinário, não são considerados medicamentos, logo não estão abrangidos no escopo dessa Portaria.
Os medicamentos de uso veterinário e os produtos intermediários medicamentosos só poderão ser comercializados para estabelecimentos autorizados pelo MAPA, ou seja, aqueles que se comprometem em cumprir os critérios e procedimentos de fabricação de produtos com medicamentos. No entanto, os produtos de pronto uso medicamentosos podem ser adquiridos diretamente pelos produtores rurais sem autorização prévia, visto que essa classe de produto não será manipulada em uma fábrica na propriedade.
Fabricantes Registrados X Fabricantes Produtores Rurais
Conforme relatado anteriormente, se o estabelecimento fabrica produtos medicamentosos destinados à alimentação de seus próprios animais, ou seja, não transfere (a qualquer título) tais produtos para outros estabelecimentos, ele será enquadrado como fabricante produtor rural.
No entanto, aqueles estabelecimentos fabricantes que pretendem transferir a propriedade, posse ou detenção desses produtos para pessoas físicas ou jurídicas terceiras deverão ser registrados.
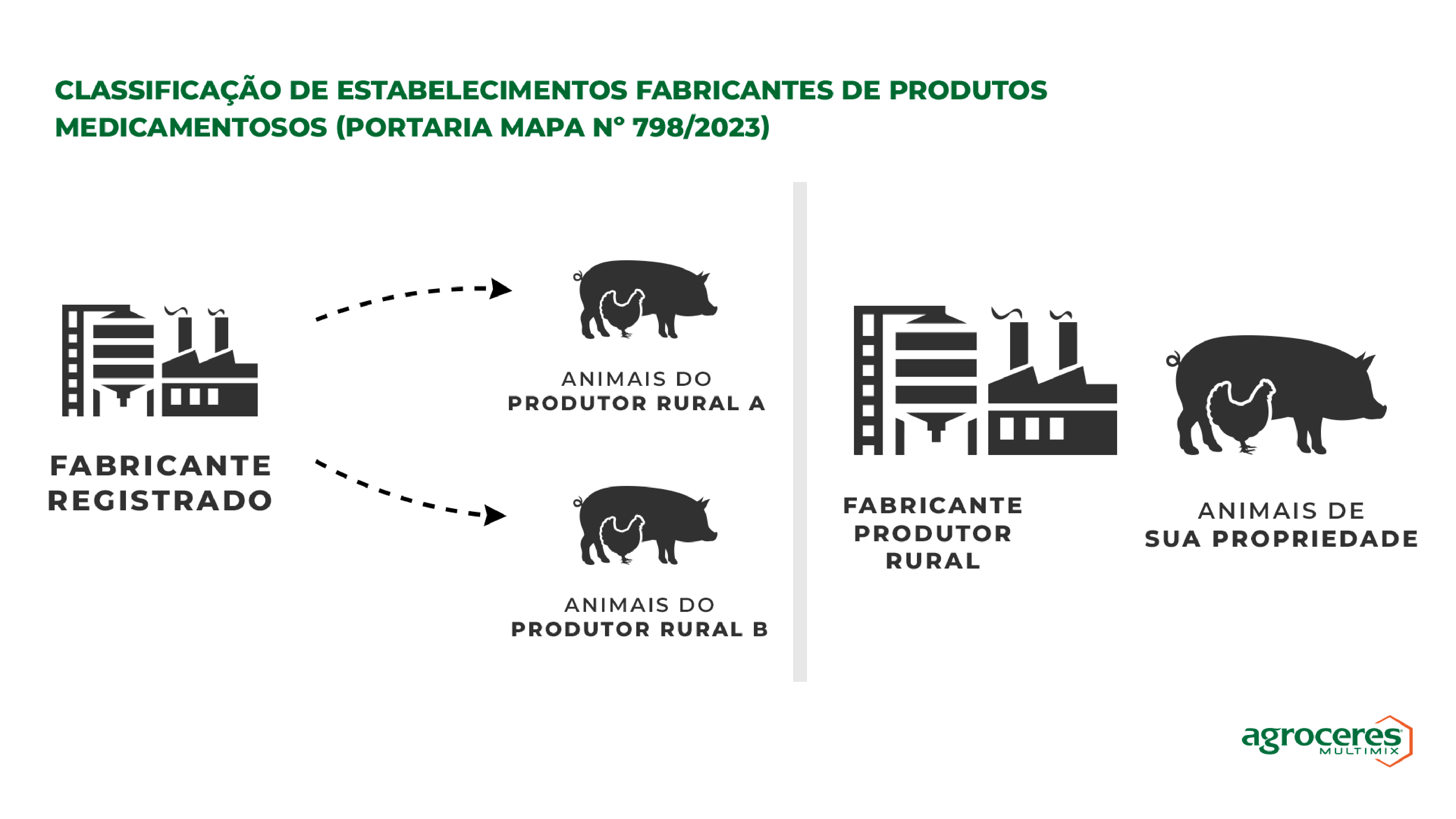
Importante: nos casos em que o produtor rural possui mais de uma propriedade e todos os animais são seus, no entanto a fábrica que alimenta tais animais fica em um destes estabelecimentos, essa atividade não caracteriza transferência de propriedade ou posse. Logo, não há necessidade de registro do estabelecimento. Já as fábricas que pertencem a um sistema de integração, ou cooperativa, são consideradas estabelecimentos registrados.
Conforme legislação vigente (Decreto Nº 6296/2007), todo estabelecimento registrado deve ter implementado um conjunto de procedimentos que caracterizam as Boas Práticas de Fabricação (BPF), as quais são objeto de fiscalização periódica pelo MAPA para avaliação do cumprimento dessas obrigações. Ainda que não sejam registrados, os fabricantes produtores rurais também precisam atender as exigências de BPF (Instrução Normativa Nº 04/2007), adotando medidas para evitar a contaminação cruzada dos produtos.
Isso significa que os fabricantes produtores rurais devem atender as mesmas regras dos estabelecimentos registrados?
Com a nova Portaria, o MAPA estabeleceu uma sistemática de caracterização de risco da atividade dos fabricantes produtores rurais, baseada na sua abrangência, para adequar o grau de exigência dos estabelecimentos. Para tal, é levado em consideração a quantidade de espécies e categorias animais que o estabelecimento rural atende, bem como o número total de animais atendidos, independentemente do número de propriedades sob sua responsabilidade. Assim, quanto maior o grau de abrangência do estabelecimento, maior o risco da atividade e, por consequência, maior é o grau de exigência.
São estabelecidas três categorias de risco para os fabricantes produtores rurais: Grupos A, B e C, numa escala crescente de risco, sendo o grupo A o de menor risco e o grupo C de maior risco.
No quadro abaixo constam as características dos estabelecimentos para enquadramento nos referidos grupos de risco da sua atividade:
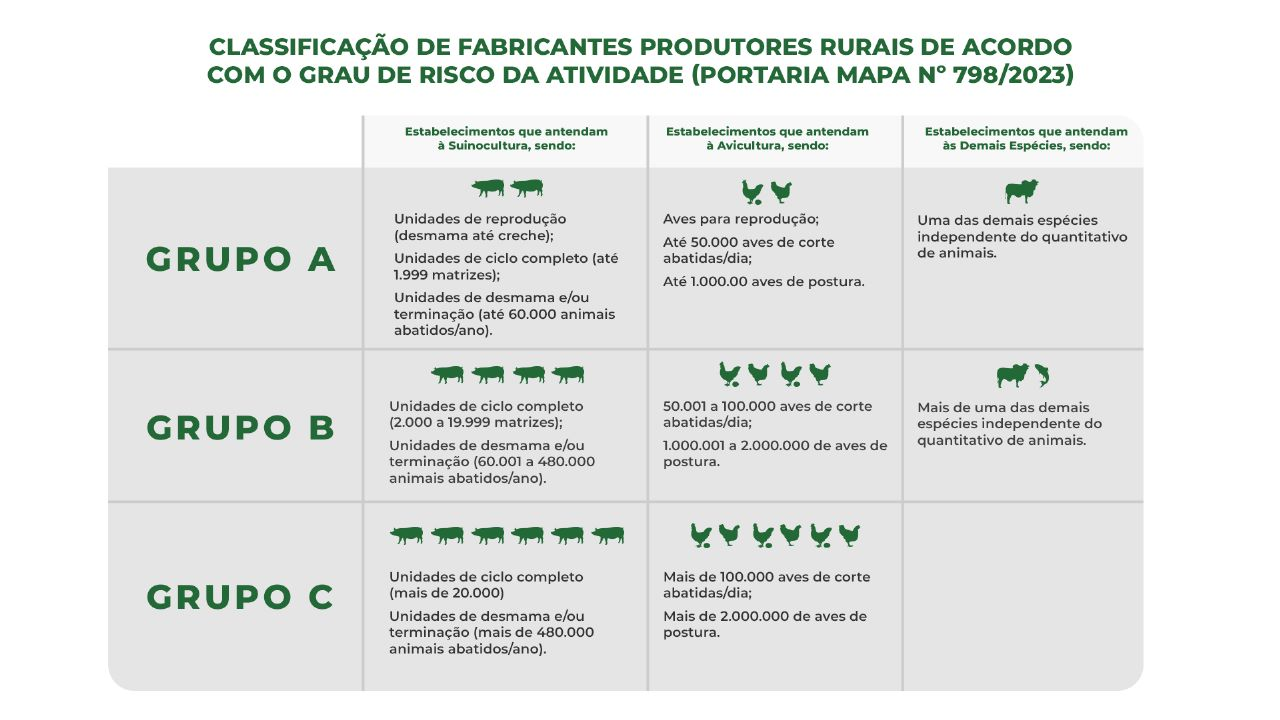
Nos casos em que o produtor rural se enquadra em mais de um grupo de risco para a mesma espécie animal, irá prevalecer o grupo de maior risco para sua atividade. Se houver produção para mais de uma espécie animal, em que uma delas seja suíno ou aves, irá prevalecer o critério mais rigoroso que corresponda a essas duas espécies.
As exigências para concessão de autorização aos estabelecimentos e as obrigações que deverão ser cumpridas para fabricação de produtos medicamentosos para cada grupo são apresentadas a seguir.
Condições para autorização dos estabelecimentos fabricantes
O que é preciso apresentar ao MAPA para que minha fábrica esteja autorizada a empregar medicamentos nos produtos?
As informações e documentos que deverão ser apresentados no sistema informatizado do MAPA, assim como a necessidade ou não de fiscalização prévia, irão depender do grupo que o estabelecimento se enquadra, conforme o ilustrado abaixo:
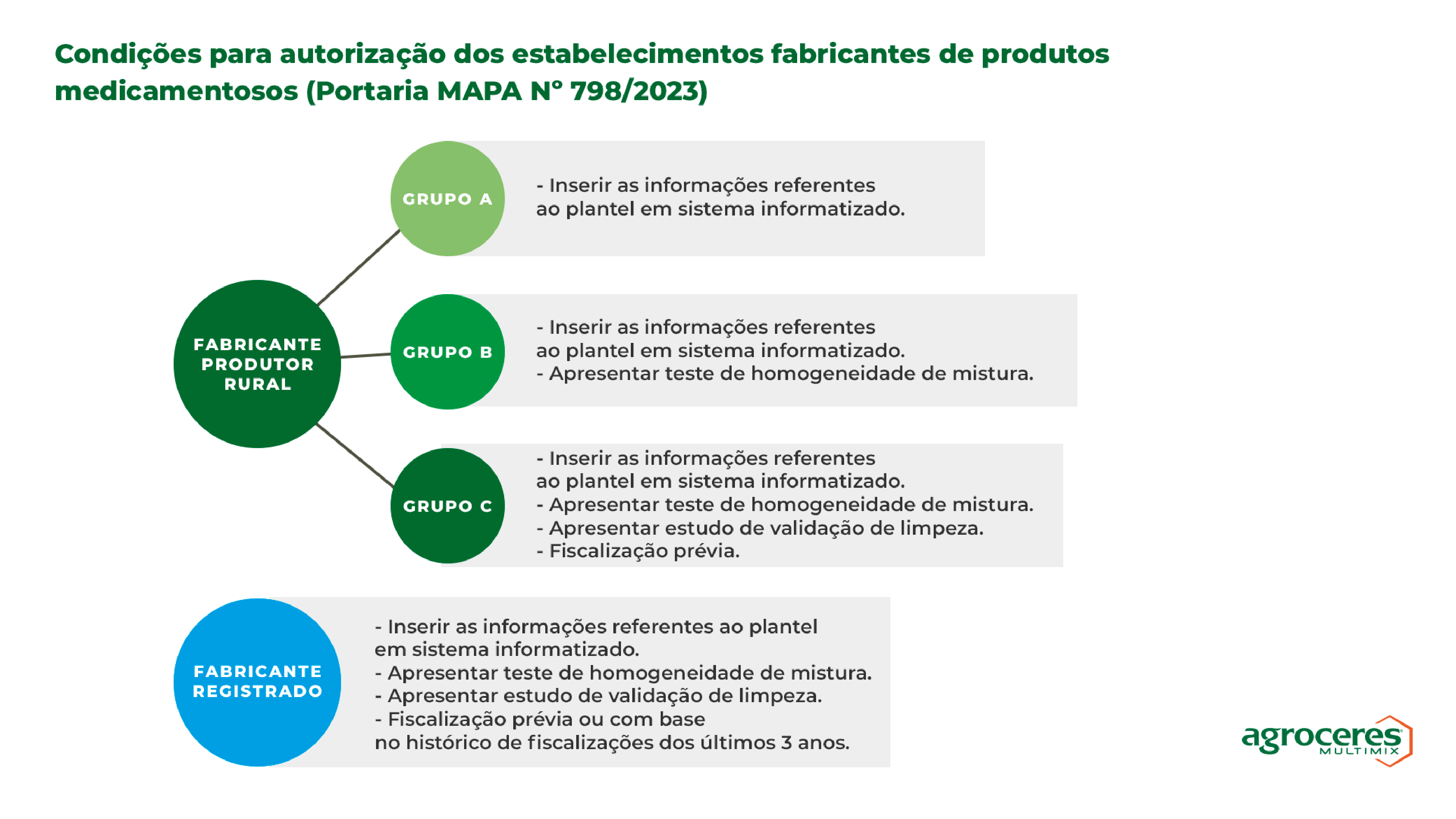
Observação: Independentemente do grupo que o estabelecimento pertence, todos estarão sujeitos à fiscalização e devem cumprir com as suas obrigações.
Obrigações dos estabelecimentos fabricantes
Meu estabelecimento foi caracterizado como de baixo risco (Grupo A), ainda assim tenho que cumprir determinadas regras?
Todo estabelecimento autorizado a fabricar produtos medicamentosos destinados a animais de produção, independentemente do grupo de risco, devem cumprir as seguintes obrigações básicas:
- Manter em arquivo as prescrições e os documentos fiscais;
- Manter os registros de fabricação dos produtos medicamentosos e de rastreabilidade do fornecimento de cada lote;
- Estabelecer uma sequência de fabricação baseada na matriz de sensibilidade;
- Manter os registros dos procedimentos de limpeza de equipamentos;
- Identificar os produtos (para vincular aos registros de fabricação e rastreabilidade);
- Realizar o teste de homogeneidade de mistura no mínimo a cada doze meses;
- Manter os registros (físicos ou eletrônicos) de fabricação e rastreabilidade por dois anos.
E os estabelecimentos de maior risco (Grupo C), possuem obrigações adicionais?
Os fabricantes produtores rurais enquadrados no grupo C de risco deverão adotar medidas de controle adicionais, similar as obrigações requeridas para os estabelecimentos registrados, as quais contemplam:
- Abordar nos procedimentos operacionais padrão (POPs) de BPF o uso de medicamentos e/ou produtos medicamentosos;
- Validar os procedimentos de limpeza e/ou plano de sequenciamento da produção;
- Registrar os desvios e elaborar um plano de ação com identificação das possíveis causas, as ações corretivas propostas e os resultados que indiquem a retomada de controle dos riscos;
- Reavaliar os procedimentos de autocontrole aos constatar desvios;
- Monitorar o atendimento dos limites máximos de resíduos em produtos não-alvo (via princípio ativo ou métodos indiretos);
- Verificar o atendimento dos limites máximos de resíduos em produtos não-alvo no mínimo a cada 12 meses (pelo princípio ativo mais crítico);
- Verificar a quantidade de princípio ativo (ao menos um) em produtos-alvo no mínimo a cada 12 meses, com limite de tolerância aceitável de 10% da dose recomendada;
- Monitorar a limpeza dos veículos graneleiros (não sendo necessário a validação da limpeza).
E quais são as obrigações exclusivas dos estabelecimentos registrados?
Para os estabelecimentos registrados, além da necessidade de cumprirem integralmente as exigências apresentadas nos tópicos anteriores, estes devem atender regras específicas de rotulagem dos produtos medicamentosos, visto que transferem a sua propriedade ou posse para terceiros, garantindo assim o adequado uso dos mesmos.
Na Portaria são detalhadas as informações obrigatórias de rotulagem (Anexo I), mas basicamente contemplam:
- a expressão “MEDICAMENTOSO” para os produtos;
- a identificação dos princípios ativos dos medicamentos utilizados e suas concentrações;
- instruções de modo de uso, duração do fornecimento, período de carência e restrições.
Ainda, em se tratando de produtos intermediários medicamentosos, a proporção de inclusão no produto de pronto uso medicamentoso, bem como a concentração final de princípio ativo que os animais consumirão deverão ser expressas.
Importante: Embora os fabricantes produtores rurais não comercializem seus produtos e, portanto, não precisam atender regras obrigatórias de rotulagem, seus produtos devem ser adequadamente identificados, de modo a garantir o correto uso e rastreabilidade.
A prescrição médico-veterinária
Continua sendo necessário prescrição médico-veterinária para fabricação de produto medicamentoso?
A exigência de prescrição dependerá da finalidade da terapêutica que o medicamento está sendo recomendado pelo médico veterinário. A Portaria descreve três finalidades terapêuticas para o emprego de medicamentos via alimentação animal:
- tratamento (para um grupo de animais doentes),
- metafilaxia (para um grupo que contém animais saudáveis e doentes), ou
- profilaxia (para um grupo de animais em risco de adquirir uma doença).
Nos casos em que produtos medicamentosos de pronto uso (ração ou suplemento) serão utilizados para o tratamento ou metafilaxia de doenças, continua sendo obrigatória a necessidade de prescrições médico-veterinárias, emitidas previamente às fabricações dos produtos.
Importante: A prescrição é válida em todo território nacional e passa a ter validade de dez dias (antes eram trinta dias), a contar da data de sua emissão.
Observação: Em se tratando de sistemas de produção cooperado ou integrado, o médico veterinário pode redigir uma única prescrição contendo mais de uma propriedade.
Os programas sanitários
Outra novidade desse regulamento é para os casos em que os produtos medicamentosos serão utilizados com a finalidade profilática, onde os programas sanitários das propriedades podem substituir as prescrições médico-veterinárias.
Mas atenção, o uso profilático deve estar previsto na bula do medicamento.
Os programas sanitários deverão ser reavaliados a cada seis meses e devem estar disponíveis na fábrica do produto de pronto uso medicamentoso, mantendo correspondência com os registros de fabricação.
Tanto as prescrições médico-veterinárias como os programas sanitários devem conter informações obrigatórias de detalhamento, que seguem no Anexo II deste artigo.
Observação: Os fabricantes de produtos intermediários medicamentosos (núcleo, premix e concentrado) estão dispensados de receber a prescrição médico-veterinária ou o programa sanitário, porém a produção destes somente poderá ser demandada pelo fabricante de ração ou suplemento medicamentoso que esteja autorizado ao uso. Portanto, serão necessários registros que fundamentem a elaboração de tais produtos.
Atenção, Médico Veterinário!
Poderão ser prescritas doses de medicamentos diferentes das que constam na bula dos medicamentos?
Via de regra, não! Apenas em caráter excepcional (em caso de indisponibilidade temporária de produtos no mercado; de doenças exóticas e situações emergenciais; ou ainda quando o medicamento tenha demonstrado ineficácia clínica quando usado de acordo com as recomendações de bula) poderão ser aceitas doses diferentes das estabelecidas em bula. Nesses casos, o médico-veterinário precisa comunicar ao Departamento de Inspeção de Produtos de Origem Animal (DIPOA) do MAPA, por meio de sistema eletrônico, e apresentar justificativa baseada em referências internacionalmente aceitas e com adequação do período de carência do produto.
Observação: É obrigatório conter nesta prescrição a informação “prescrição em caráter excepcional” e indicar a justificativa de recomendação de dose diferente da bula do medicamento.
Importante: O médico veterinário se responsabiliza pelas prescrições com doses diferentes da bula.
E os fármacos poderão ser associados para uso na fabricação de produtos medicamentosos?
Da mesma forma, toda inclusão e associação de fármacos em um produto para alimentação animal deve ter amparo científico.
Boas práticas de fabricação e medidas de controle da contaminação cruzada
Qual o limite de CV aceitável para considerar uma mistura de produto medicamentoso homogênea?
A Portaria reforça a todo momento a importância das BPFs e um dos seus requisitos inclui o monitoramento da homogeneidade da mistura para todos os estabelecimentos fabricantes.
Uma mistura homogênea é caracterizada pela distribuição uniforme dos componentes da mistura em qualquer porção do produto, logo o teste de homogeneidade avalia a capacidade do misturador em realizar uma boa mistura.
Como novo critério deste regulamento para definir se a mistura é homogênea, o limite do coeficiente de variação (CV) deve ser inferior a 10% (antes era 5%), quando avaliada a concentração do princípio ativo do medicamento, ou de uma substância usada como indicador que possua amparo na literatura.
Quando a homogeneidade da mistura for avaliada por meio da contagem de partículas (“microtracers”) o seu resultado deverá ser apresentado em termos de probabilidade, com limite aceitável maior que 5%.
Qual o limite máximo de contaminação cruzada para validar a eficiência dos procedimentos de limpeza da linha de produção?
Dentre as diversas medidas de controle estabelecidas para mitigar os riscos de contaminação cruzada na fabricação de produtos medicamentosos, está a validação do procedimento de limpeza adotado na fábrica.
O resultado do estudo de validação poderá ser considerado satisfatório quando o valor encontrado de resíduo de medicamento no produto fabricado imediatamente após o procedimento de limpeza for menor ou igual a 2,5% (antes era 1%) da concentração de princípio ativo do produto medicamentoso utilizado no estudo.
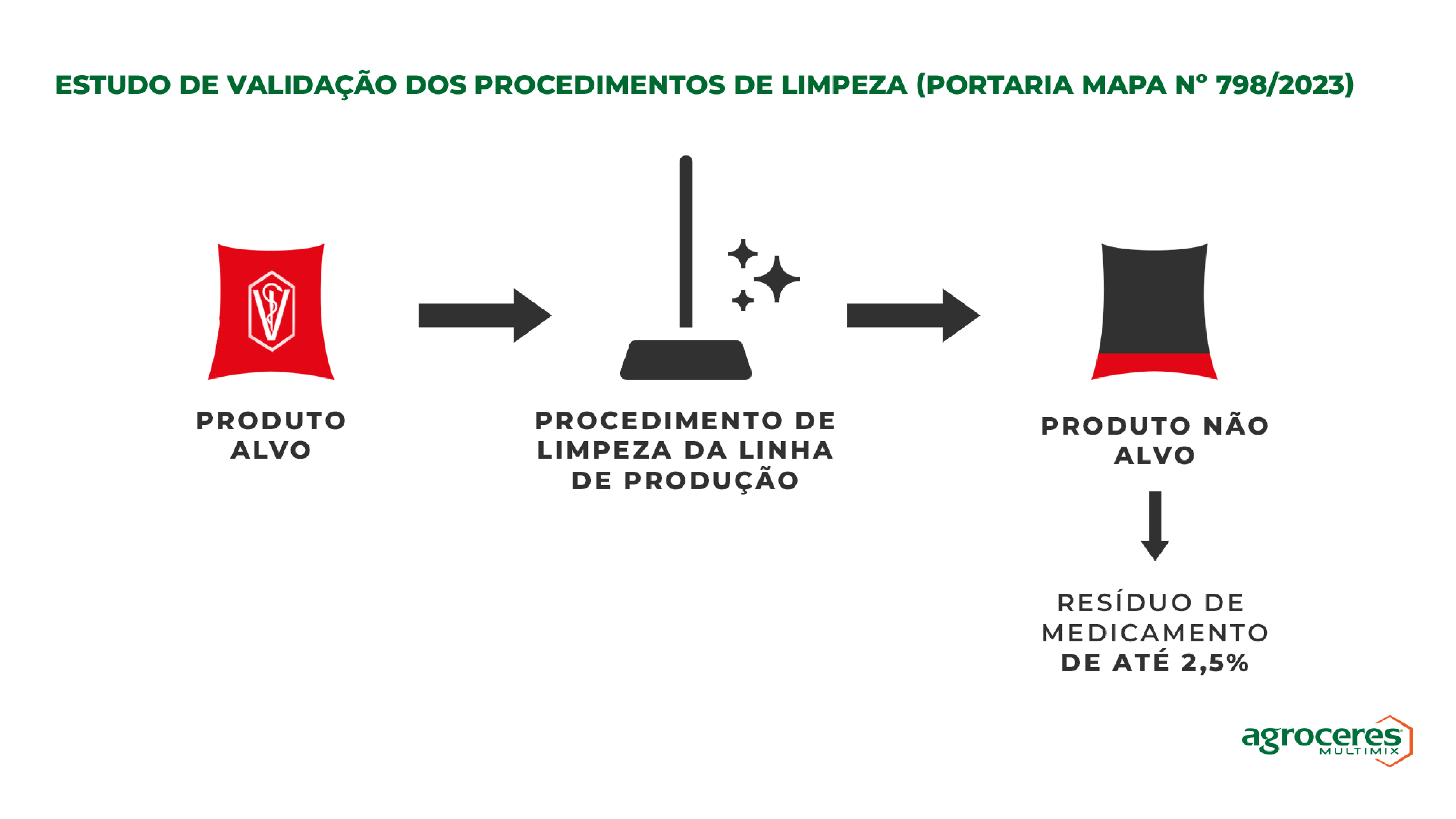
Observação: Embora os procedimentos de limpeza devem ser empregados nos processos de fabricação de todos os fabricantes de produtos medicamentosos, a necessidade de validação se aplica aos fabricantes registrados e aos fabricantes produtores rurais do grupo C de risco.
Como devo armazenar, embalar e transportar os medicamentos e produtos medicamentosos?
Medicamentos de uso veterinário e produtos medicamentosos devem ser identificados e armazenados em local separado dos outros produtos para evitar a contaminação, sob condições de conservação recomendadas pelos fabricantes.
Para garantir a qualidade e a inviolabilidade de produtos medicamentosos, estes só poderão ser transportados em embalagem ou recipiente fechado.
Observação: Veículos graneleiros apropriados para transporte de produtos para alimentação animal poderão ser utilizados, desde que garantam a qualidade e a inviolabilidade, e que sejam executados procedimentos de limpeza.
Ainda, a nova lei prevê a possibilidade de uso de centros de distribuição para comercialização de produtos medicamentosos entre fabricantes e solicitantes, desde que sejam garantidas a qualidade e a rastreabilidade.
Importante: Continua sendo vedado ao produtor comercializar produtos medicamentosos.
Responsabilidades aplicáveis
Quem poderá ser responsabilizado caso sejam constatados desvios e irregularidades?
A Portaria enfatiza que todos os envolvidos (médicos veterinários, gerentes, responsáveis técnicos e colaboradores dos estabelecimentos fabricantes, bem como os produtores rurais) na cadeia de fabricação e no emprego de medicamentos e produtos medicamentosos na alimentação animal devem ter capacitação para o uso responsável.
Ainda, TODOS estão sujeitos a sanções administrativas aplicáveis caso forem considerados responsáveis pela violação dos limites máximos de resíduos nos produtos de origem animal (carne, leite, ovos e derivados), conforme Plano Nacional de Controle de Resíduos e Contaminantes (PNCRC) do MAPA.
Fique atento ao prazo!
Essa nova Portaria entra em vigor no dia 1º de junho de 2023 e os estabelecimentos terão 180 dias para se adequarem aos novos procedimentos (data limite de 28 de novembro de 2023).
Informação complementar: Ficam excluídos do âmbito de aplicação da Portaria Nº 798/2023 o emprego de medicamentos de uso veterinário administrados por via oral, misturados à água de bebida e os que são diretamente despejados nos comedouros; e os fabricantes que utilizam somente medicamentos de uso veterinário homeopáticos (excetuando as regras de rotulagem e o monitoramento da homogeneidade da mistura, que seguem válidas para este último grupo). A Portaria também destaca a proibição do uso de medicamentos em produtos para alimentação de animais de companhia.
INFORMAÇÕES EXTRAS
O Antes e o Depois
Veja o resumo das principais mudanças com a publicação da Portaria Nº 798/2023 em relação às antigas regras (IN Nº 65/2006 e IN Nº 14/2016) sobre o uso de medicamentos na alimentação animal:
- Não há mais distinção de regras aplicáveis aos estabelecimentos que manipulam medicamentos de uso veterinário e produtos intermediários medicamentosos;
- Os estabelecimentos fabricantes “para uso próprio” passam a ser classificados quanto ao grau de risco da sua atividade (Grupos A, B e C), com obrigações distintas entre os grupos;
- Passam a ser aceitos registros eletrônicos de documentos;
- Alteram-se algumas informações obrigatórias de rotulagem (usar a expressão “MEDICAMENTOSO” após categoria do produto ao invés de “COM MEDICAMENTO DE USO VETERINÁRIO”; para produto intermediário medicamentoso, constar a proporção de inclusão no produto de pronto uso medicamentoso);
- Passa a ser aceito Programa Sanitário ao invés de Prescrição Veterinária para os casos em que o medicamento for utilizado de modo profilático;
- A Prescrição Veterinária passa a ter validade de 10 dias ao invés de 30 dias;
- O Programa Sanitário e a Prescrição Veterinária serão obrigatórios apenas para fabricação de rações e suplementos medicamentosos, tornando-se facultativa para fabricantes das demais categorias de produtos;
- Para atestar sobre a homogeneidade da mistura, o limite de CV passa de 5% para 10%;
- Para validar o procedimento de limpeza, o limite de resíduo de medicamento passa de 1% para 2,5% no produto fabricado após a limpeza;
- A recomendação médico-veterinária de associação de fármacos, bem como o uso “extra bula” de medicamentos, passam a ter a exigência justificativa com amparo científico para uso.
Listas de medicamentos e estabelecimentos autorizados
Onde posso consultar os medicamentos que podem ser utilizados na alimentação animal? Como sei se o fabricante que desejo comprar o premix medicamentoso está devidamente registrado e autorizado pelo MAPA? E como o fabricante do premix medicamentoso que pretendo adquirir para fazer uma ração medicamentosa saberá que estou autorizado a comprar esse produto?
O MAPA manterá em seu sítio eletrônico a relação de medicamentos e de estabelecimentos autorizados para consulta de informações, mantendo-as atualizadas. Segue os links já disponíveis:
Medicamentos de uso veterinário registrados no MAPA que podem ser empregados na alimentação animal:
Informações sobre os estabelecimentos registrados e autorizados à fabricação de produtos medicamentosos:
Informações sobre os produtores rurais autorizados à fabricação de produtos medicamentosos:
ANEXOS
Anexo I – Informações obrigatórias, além das estabelecidas em regulamento específico (IN Nº22/2009), para rotulagem de produtos medicamentosos:
I – a expressão “RAÇÃO MEDICAMENTOSA ou SUPLEMENTO MEDICAMENTOSO ou PREMIXMEDICAMENTOSO ou NÚCLEO MEDICAMENTOSO ou CONCENTRADO MEDICAMENTOSO”, em destaque;
II – a identificação do(s) princípio(s) ativo(s) do(s) medicamento(s) de uso veterinário utilizado(s) e sua concentração em unidade de medida adequada por quilograma do produto;
III – as instruções sobre o modo de uso e duração do fornecimento do produto de pronto uso medicamentoso;
IV – as informações sobre restrições e período de carência ou retirada, ainda que zero, em destaque, conforme determinado no rótulo do medicamento de uso veterinário;
V – a proporção de inclusão do produto intermediário medicamentoso em um produto de pronto uso medicamentoso; e
VI – a informação sobre a concentração do(s) princípio(s) ativo(s) do(s) medicamento(s) de uso veterinário que deverá estar presente na ração ou suplemento de pronto uso a ser fornecido aos animais.
Anexo II – Informações obrigatórias da prescrição médico-veterinária e do programa sanitário:
I – identificação da espécie, categoria animal, peso médio e consumo médio de ração aproximado dos animais;
II – princípio(s) ativo(s) prescrito(s) sob a forma de Denominação Comum Brasileira – DCB ou, na sua ausência, Denominação Comum Internacional – DCI;
III – dose(s) do(s) princípio(s) ativo(s) a ser(em) administrada(s) aos animais em mg/Kg ou UI/Kg de peso corpóreo;
IV – finalidade da terapêutica (profilática, metafilática ou tratamento);
V – concentração do princípio(s) ativo(s) no produto medicamentoso a ser fornecido aos animais em unidade de medida adequada por quilograma do produto de pronto uso.
VI – agente etiológico, quando couber;
VII – duração do tratamento;
VIII – identificação do(s) proprietário(s) e da(s) propriedade(s), com endereço completo, incluindo o número de animais do rebanho a serem tratados (no caso de organismos aquáticos, a biomassa dos animais);
IX – período de carência (indicar zero quando não houver período de carência);
X – identificação do médico-veterinário, endereço eletrônico, sua inscrição no conselho de classe e assinatura (física ou eletrônica);
XI – local e data da emissão; e
XII – a indicação ‘utilizar por única vez’.